CRC如何與研究者、CRA、機構倫理等多方達成有效溝通?
何所謂溝通?溝者,構筑管道也;通者,順暢也。溝通是人與人之間以及人與群體之間思想與感情的傳遞和反饋的過程,以求思想達成一致和感情的通暢。溝通的目的是讓對方達成行動
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
2021年來了,讓我們一起來看看哪些公告機構在2020年獲得了MDR/IVDR的資質,你所中意的機構是否在名單中。

原本歐盟醫療器械法規的過渡期到2020年5月就結束了,因為全球疫情的原因,該過渡期也被延長了一年。這對生產商來說,又多了一個緩沖,對于很多公告機構來說也是一樣。截止2020年12月底,幾個主要的醫療器械公告機構都獲得了MDR的資質,也有少數公告機構獲得了IVDR的資質。
已獲得MDR資質的公告機構包括(按公告機構名稱排序):
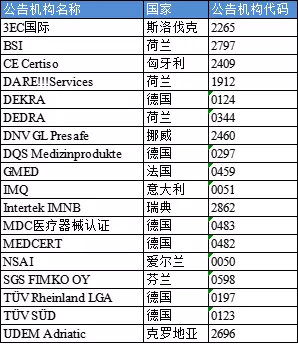
已獲得IVDR審核資質的公告機構(按公告機構名稱排序):
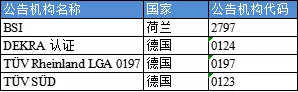
除了上述已經獲得資質的公告機構之外,其他公告機構也在積極地申請資質。歐盟委員會表示,目前90%的MDD和71%的IVDD公告機構正在申請資質。但是新冠疫情阻擋了現場審查的進程,而只有通過最后階段的現場審查后公告機構才能被指定。不知道隨著現有情況的發展,歐盟委員會是否會對公告機構進行遠程審核。
目前申請中的公告機構包括(按公告機構名稱排序):
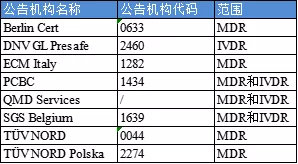

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

何所謂溝通?溝者,構筑管道也;通者,順暢也。溝通是人與人之間以及人與群體之間思想與感情的傳遞和反饋的過程,以求思想達成一致和感情的通暢。溝通的目的是讓對方達成行動

在臨床試驗中,無論是監查員、質控人員或者項目管理人員到研究中心查看項目資料的時候,總會多多少少發現一些問題,有些問題可能大家都比較熟知,但處理手法五花八門的。處理

2019-12-01藥物臨床試驗機構(簡稱機構)開始實行備案管理。本文結合機構備案平臺構建思路,著重介紹了備案平臺的結構組成以及相關要求,梳理了機構備案過程中的常見問題,對機構

成人用品大多屬于二類醫療器械,在網絡銷售成為情趣用品銷售主要渠道的今天,除了辦理二類醫療器械經營備案憑證之外,在網上銷售情趣用品還要辦理什么證嗎?"

臨床試驗機構和研究者是臨床試驗實施的主體,高質量的試驗研究必須依賴于有能力有責任的機構和研究者方能完成,因此,機構和研究者的選擇是關乎試驗的成敗的關鍵環節之一。選

MDR 2017/745號法規附錄VIII中詳定了22條分類規則。根據器械的預期用途和其固有風險,醫療器械應分為:I、IIa、IIb和III類。"
我國法規規定,開展醫療器械臨床試驗的機構需要具備相應的硬件、軟件和人力資源能力要求,醫院、防疫站等機構辦理醫療器械臨床試驗機構備案后,方可開展醫療器械臨床試驗。"

歐盟自由銷售證明是指歐盟國家主管當局出具的自由銷售證書,全稱為Certificate of Free Sale或Free Sales Certificate,簡稱CFS或FSC。本文重點講解企業申請歐盟自由銷售證書的條件和自由銷售證
早在2017年11月24日CFDA和衛計委就聯合發布《醫療器械臨床試驗機構條件和備案管理辦法》(2017年第145號),把臨床試驗機構的資格認定,改為備案管理。目前,醫療器械臨床試驗機構備案

昨天,同事在臨床試驗機構備案服務投標時,有醫療機構要求必須4個月內完成備案,在了解到醫療機構研究者缺乏項目經驗,屬于零工作基礎且對備案時限有明確要求情況下,未進行投
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
