臨床新藥試驗四期內容及方案設計要點
我國《藥品注冊管理辦法》規定臨床試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ臨床試驗在藥品上市前進行,而Ⅳ期臨床試驗是新藥臨床試驗的一個重要組成部分,是對新藥上市前Ⅰ
來源:醫療器械注冊代辦 發布日期:2023-10-10 閱讀量:次
?
不管是在中國還是國外,都有方案將AE的開始收集時間定義為簽署ICF之后就開始收集,而不是等到首次研究治療/干預/用藥。根據檢索相關信息,這一設定的考量可能包括以下幾點(從臨床運營的角度歸納,大家有其它意見留言區補充呀~):
1.收集由于研究篩選期/洗脫期/創傷性流程等導致的醫學事件,評價研究方案的風險/獲益,及研究流程的設計是否合理;
2.在研究數據的統計分析中,首劑給藥前的AE和“治療期間出現的不良事件(TreatmentEmergent Adverse Event, TEAE)”可以分開統計,提前收集AE不會對研究藥物的安全性分析產生顯著影響;
3. 輔助臨床試驗的風險管理;

一、法規對AE收集的要求:接受試驗用藥品后
根據ICH E2A(Clinical Safety Data Management: Definitions and Standards for Expedited Report), AE被明確定義為“Anyuntoward medical occurrence in a patient or clinical investigation subject administered a pharmaceutical productand which does not necessarily have to have a causal relationship with thistreatment.” 同時指南也明確說明到:“An adverse event (AE) cantherefore be any unfavourable and unintended sign (including an abnormallaboratory finding, for example), symptom, or disease temporally associated with the use of a medicinalproduct, whether or not considered related to the medicinal product.”
同樣地在中國GCP(2020版)中,“不良事件,指受試者接受試驗用藥品后出現的所有不良醫學事件,可以表現為癥狀體征、疾病或者實驗室檢查異常,但不一定與試驗用藥品有因果關系。”
以上兩個GCP都僅要求,在受試者使用試驗用藥品后出現的不良醫學時間,定義為不良事件。受試者在接受研究藥物之前發生的不良事件,不應當納入研究藥物的安全性分析中。
二、法規對用藥前開始收集AE的支持性內容
中國GCP也提到:“第四條 藥物臨床試驗應當有充分的科學依據。臨床試驗應當權衡受試者和社會的預期風險和獲益,只有當預期的獲益大于風險時,方可實施或者繼續臨床試驗。”、“第三十一條 申辦者基于風險進行質量管理。(四)應當識別可減少或者可被接受的風險。減少風險的控制措施應當體現在試驗方案的設計和實施、監查計劃、各方職責明確的合同、標準操作規程的依從性,以及各類培訓。預先設定質量風險的容忍度時,應當考慮變量的醫學和統計學特點及統計設計,以鑒別影響受試者安全和數據可靠的系統性問題。出現超出質量風險的容忍度的情況時,應當評估是否需要采取進一步的措施。”
申辦方出于風險管理的考量,將方案的篩選/診斷/洗脫期/無治療期所導致的重要醫學事件進行收集,有利于申辦方更好地進行風險管理。例如方案中對洗脫期進行了明確規定(例如交叉治療方案),可能發生戒斷癥狀/病情加重。如果在此類環節中產生的重要醫學事件風險超過了可接受范圍,方案應當進行相應的調整。方案也可能考慮通過系統性收集、比較研究藥物給藥前后發生的的醫學事件,便于確認基線、排除研究流程的影響。
三、其他內容
對于一個特定研究,在AE開始收集事件的設定,應當考慮篩選期流程及篩選期操作可能導致的損傷。對于I期健康人臨床試驗,在收集給藥后再開始AE的收集足以滿足試驗的要求。
但對于篩選期流程漫長、操作復雜、存在創傷性流程的方案,應當考慮在簽署ICF后就開始收集AE。例如在溶栓藥物治療缺血性中風的臨床試驗中,篩選期會包括使用CT及動脈造影以評估凝血塊的位置和大小。而這個流程就可能對受試者產生不良事件/損傷。在急性病的臨床試驗中,由于參與臨床試驗,受試者為完成篩選期流程繼而進入研究治療所花費的時間,可能遠遠長于臨床常規診療所需要的時間。而在這一環節中,受試者也可能因延誤的時間產生新的不良醫學事件,此類情況需要進行統計,納入方案涉及的考量中。單純將此類事件記錄為病史,會導致難以評估研究設計引入的風險大小。
除此之外,在實驗數據的統計分析階段,研究藥物首劑給藥前的AE,可以和“治療期間出現的不良事件(Treatment Emergent Adverse Event, TEAE)”分開統計。試驗藥物的安全性分析可以主要基于TEAE。在這一情況下,即使收集給藥前的AE,只要在統計分析中進行明確區分,也不會對藥物的安全性信息產生顯著影響。
歡迎留言指正討論
外網回答參考:https://www.therqa.com/forum/good-pharmacovigilance-practice-discussion-forum/thread/3951/
外網回答參考:https://www.spirit-statement.org/harms/
書籍:Good Clinical Practice: A Question& Answer Reference Guide 2017
https://database.ich.org/sites/default/files/E2A_Guideline.pdf
藥物臨床試驗質量管理規范GCP
來源:煎茶員日記

站點聲明
本網站所提供的信息僅供參考之用,并不代表本網贊同其觀點,也不代表本網對其真實性負責。圖片版權歸原作者所有,如有侵權請聯系我們,我們立刻刪除。如有關于作品內容、版權或其它問題請于作品發表后的30日內與本站聯系,本網將迅速給您回應并做相關處理。
鄭州思途醫療科技有限公司專注于醫療器械產品政策與法規規事務服務,提供產品注冊備案申報代理、臨床試驗、體系建立輔導、分類界定、申請創新辦理服務。

我國《藥品注冊管理辦法》規定臨床試驗分為Ⅰ、Ⅱ、Ⅲ、Ⅳ期,其中Ⅰ、Ⅱ、Ⅲ臨床試驗在藥品上市前進行,而Ⅳ期臨床試驗是新藥臨床試驗的一個重要組成部分,是對新藥上市前Ⅰ

方案偏離和方案違背是我們在平時工作過程中,非常容易遇到的一種情況,今天,我們就來聊一下應該 如何做才能更好的降低方案偏離/違背發生呢? 1.定義 其實GCP中并未對方案偏離

大家在項目中,是否遇到過ICF更新的情況?在ICF更新后,已由受試者簽署的知情同意書,是否需要重新簽署呢?又有哪些情形不需要重新簽署呢?本期我們繼續跟大家分享知情同意書實

PD和PV,對于工作久的CRA來說,是個比較困惑的問題,因為對于方案違背和方案偏離的定義,每個公司SOP或不同項目的要求不一樣。有些公司只有PD,有些公司PD和PV分得很清楚,經歷了幾

在臨床試驗方案的設計過程中,大家都會盡可能的考慮到各種可能影響試驗的因素,并制定標準操作規程,盡量避免和減少在試驗中可能出現違背及偏離方案的情況發生,但在試驗的執

知情同意對從事臨床的CRC來說,并不陌生。日常工作中每時每刻都在與臨床試驗受試者溝通交流,那么你知道知情同意書簽署注意事項及核查要點嗎?我們先來區分知情同意和知情同意

我們學習了什么是PD(方案偏離)和PV(方案違背),那么問題就來了:很多國內小公司和小藥企,臨床醫學團隊不是很完善(結構就是:醫療器械臨床試驗公司配備一個經理+幾個CRA),

在過去幾年的工作中,我發現SAE上報既是臨床試驗工作中的重點難點,也是CRC工作中的痛點。當你是小白時,看到SAE就很頭大,天然地產生一種畏懼心理,談SAE色變,當你經驗比較豐富

醫療器械臨床試驗中違背方案的情況時有發生,難以避免。我們需要學習和借鑒國際多中心臨床試驗項目試驗設計嚴謹科學、操作流程標準化及數據處理真實等做法,以切實減少方案違
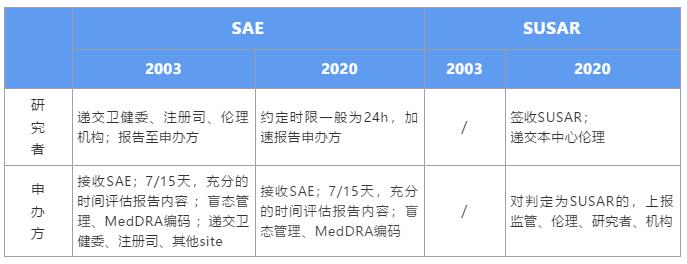
新版GCP對于申辦方的影響是全方位的,就SAE個例報告處理方面,強化了申辦方的主體責任,細化了申辦方對SAE的管理流程。在此,我們詳細解讀,在新規之下,該如何高效、合規的處理
行業資訊
知識分享
八年
醫療器械服務經驗
聯系思途,免費獲得專屬《落地解決方案》及報價
咨詢相關問題或咨詢報價,可以直接與我們聯系
思途CRO——醫療器械注冊臨床第三方平臺
